由单纯疱疹病毒1型(HSV-1)感染引起的单纯疱疹病毒性角膜炎(HSK)是世界范围内单侧角膜失明的主要原因。据估计,每年有150万例HSK病例发生,其中4万例发展为严重视力障碍。三叉神经节(TG)是HSV-1在原发性急性角膜感染后在宿主中建立终生潜伏的地方,TG神经元中潜伏的HSV-1会重新激活导致反复感染。
2021年5月,上海交通大学系统生物医学研究院蔡宇伽研究员与复旦大学附属眼耳鼻喉科医院洪佳旭主任医师开发了名为HELP的瞬时靶向基因编辑技术实现了小鼠病毒性角膜炎的完全治愈【1】。HELP技术使用了蔡宇伽团队开发的类病毒载体(VLP),以mRNA的形式递送CRISPR-Cas9基因编辑工具,使得Cas9酶在体内停留时间很短,可更大程度地降低脱靶风险、减少免疫反应【2】。
2023年8月31日,蔡宇伽研究员、洪佳旭主任医师作为共同通讯作者,在美国基因治疗协会(ASGCT)会刊 Molecular Therapy 期刊上发表了题为:In Vivo CRISPR Gene Editing in Patients with Herpes Stromal Keratitis 的研究论文。
该研究对3名伴有急性角膜穿孔的严重难治性单纯疱疹病毒性角膜炎(HSK)患者进行了HELP治疗联合角膜移植,并进行了平均18个月的随访。结果显示,3名患者未发生HSV-1复发,且没有检测到CRISPR诱导的脱靶效应,也未出现全身性不良事件。
这些初步临床结果表明,HELP有望成为一种全新的体内抗病毒疗法,助力体内基因编辑治疗时代的真正到来,为无药可治、有药难治的遗传性、获得性及感染性疾病的患者带来新的希望。
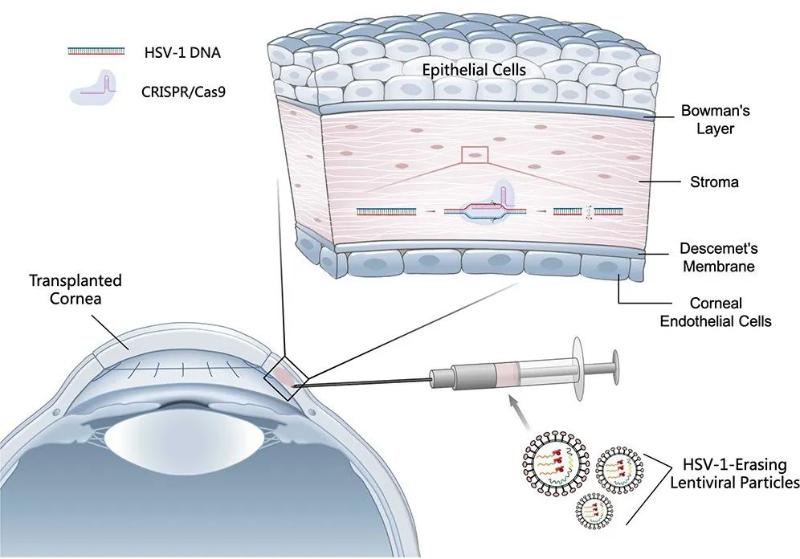
在此前的研究中,蔡宇伽和洪佳旭研究团队使用HELP技术进行了治疗病毒性角膜炎的临床前研究,在急性和复发感染的小鼠模型中实现了从角膜到三叉神经节的逆行运输,将潜藏在神经节的HSV-1病毒库清除。
体内CRISPR基因编辑治疗具有巨大的临床潜力,但其安全性和疗效仍在很大程度上未知。在这项研究中,研究团队在角膜移植术中对3例伴有急性角膜穿孔的严重难治性单纯疱疹病毒性角膜炎(HSK)患者的角膜注射了HELP。这是一项在单中心开展的调查性、开放标签、单组、非随机干预性试验(NCT04560790)。
3名患者在HELP治疗后停止了抗病毒治疗,并进行了平均18个月的随访,在末次随访时,他们的角膜移植物和泪液拭子均未见HSV-1病毒复发。
此外,研究团队使用全基因组无偏双链断裂点测序(GUIDE-seq)检测了全基因水平的CRISPR-Cas9系统脱靶情况,结果未发现由CRISPR-Cas9诱导的脱靶DNA断裂。进一步检测未发现注射HELP诱导的载体特异性免疫应答,也未发现其他全身性不良事件。
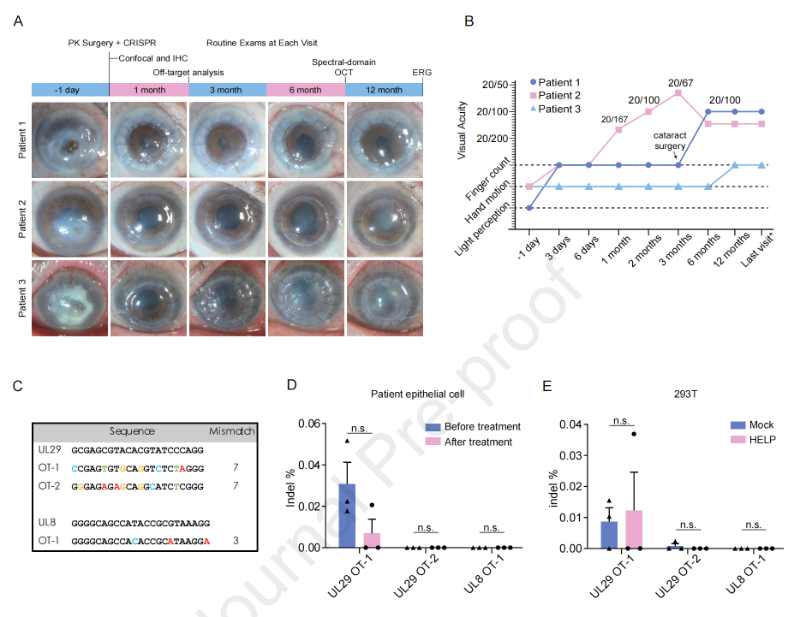
这些初步临床结果表明,HELP可能是限制人类角膜中HSV-1复制的有效策略,且无明显的CRISPR相关副作用,具有可接受的安全性。该疗法在未来还有望将治疗范围扩大到较轻的单纯疱疹病毒性角膜炎(HSK)患者,以防止他们发展为难治性HSK以及发生角膜穿孔并发症。总的来说,这项研究为体内CRISPR基因编辑作为潜在的抗病毒策略提供了临床概念验证。
版权声明:除特殊说明外,本站所有文章均为 字节点击 原创内容,采用 BY-NC-SA 知识共享协议。原文链接:https://byteclicks.com/52425.html 转载时请以链接形式标明本文地址。转载本站内容不得用于任何商业目的。本站转载内容版权归原作者所有,文章内容仅代表作者独立观点,不代表字节点击立场。报道中出现的商标、图像版权及专利和其他版权所有的信息属于其合法持有人,只供传递信息之用,非商务用途。如有侵权,请联系 gavin@byteclicks.com。我们将协调给予处理。
